《细胞》子刊:PD-1抗体抗癌的真相,我们理解错了!麻省总医院科学家发现,与PD-1抗体结合的T细胞只有收到DC细胞的指令才抗癌
我们对免疫治疗机制认识可能错了。
一直以来,大家认为只要PD-1抑制剂阻止肿瘤细胞踩免疫细胞的刹车,抗肿瘤能力自然就有了。然而,事情并可能并没有我们想象的这么简单。
最近,麻省总医院的Mikael Pittet博士领导的研究团队,在著名学术期刊Immunity上发表研究成果,刷新了我们对PD-1抗体起作用的认知。
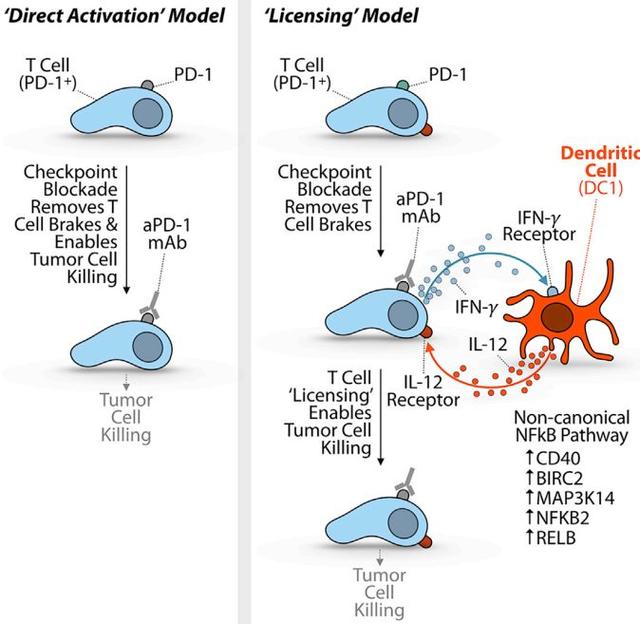
他们发现,当PD-1抗体结合到T细胞的PD-1受体上后,T细胞并没有立即获得抗癌能力;只有另一种免疫细胞——树突状细胞——发放“授权”之后,杀伤性T细胞才能发挥抗肿瘤的作用。而杀伤性T细胞与树突状细胞之间需要通过干扰素-γ(IFN-γ)和白细胞介素12(IL-12)进行信息交流,这之间涉及到一系列信号通路的激活。
此外,科学家还发现了增强PD-1抗体抗癌效果的联合治疗方法,而且这种联合治疗能使小鼠保持对肿瘤的免疫记忆,防止肿瘤复发!
这个发现表明,免疫治疗不是“兵来将挡,水来土掩”这种简单的局部攻防战,在PD-1-PD-L1这条轴线背后,可能隐藏着一条更长的战线,一个更加广阔的战场。
其实Pittet博士团队的这个发现,也属偶然。
之前的研究表明,在肿瘤内,各种细胞因子,包括IFN-γ、IL-12很活跃,并且这俩在免疫作用中扮演着重要角色[2-3]。但是人们对它们在肿瘤免疫中发挥的作用一直不是很清楚。
于是,Mikael Pittet教授团队想好好地认识下它们二位。他们将 IFN-γ和IL-12打上荧光标签,然后用一种单细胞活体成像的技术追踪这两个因子在肿瘤内的活动情况,其中肿瘤也用荧光进行了标记。
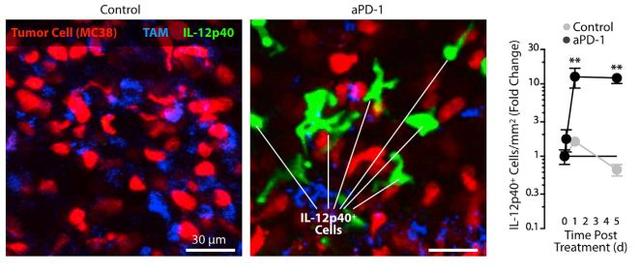
活体成像结果显示,在小鼠接受了PD-1抗体注射一天后,肿瘤中表达IFN-γ的细胞数量增加了6倍,其中最多的就是具有肿瘤杀伤功能的杀伤性T 细胞。与此同时,表达IL-12的细胞数量增加了12倍,而这些细胞在形态上很像树突状细胞,并且显示其具有运动能力。
随后,研究人员对肿瘤中的细胞进行单细胞测序,证实树突状细胞确实表达了大量的IL-12。
当他们将小鼠的树突状细胞消除后,再用PD-1抗体进行治疗时,发现小鼠对肿瘤不再有免疫反应。而当用IL-12抗体中和掉IL-12时,PD-1抗体同样不再起作用。
这说明,只有当树突状细胞表达IL-12时,免疫治疗才会发挥作用。也就是说,树突状细胞通过表达IL-12赋予了杀伤性T细胞抗肿瘤活性。
那原本置身事外的树突状细胞是如何发挥作用的呢?
研究人员将肿瘤中的杀伤性T细胞消除后,发现树突状细胞表达IL-12也被抑制了,这表明树突状细胞应该是接到了杀伤性T细胞的讯号,才开始行动。
联系到杀伤性T细胞会表达大量的IFN-γ,科学家推测IFN-γ可能就是这个发出讯号的信使。
果不其然,将IFN-γ阻断后,IL-12的表达也大幅削弱,这表明树突状细胞可能是通过感应IFN-γ,进而启动IL-12表达的。
研究人员用IL-12刺激杀伤性T细胞,发现杀伤性T细胞能够生产更多的IFN-γ。这说明,杀伤性T细胞与树突状细胞,IFN-γ与IL-12之间形成了一个相互促进的正向循环。此外,IFN-γ还能激活另一种CD28细胞,使CD28细胞拯救耗竭的杀伤性T细胞[4]。
当然,以上看起来都是一些次要的辅助作用,好像起不到决定性作用。
实际上,IL-12的主要作用在于能激活杀伤性T细胞很多功能基因的表达。
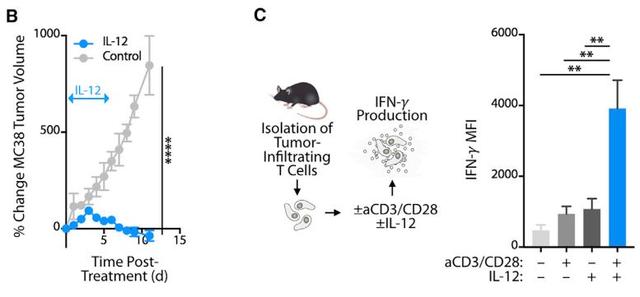
研究人员从黑色素瘤病人身上提取了免疫治疗前后的肿瘤组织,然后将IL-12编码基因转入肿瘤组织中。检测发现,随着IL-12的表达,肿瘤组织中细胞溶解基因的表达也被激活了,表明发生了肿瘤免疫反应[5]。
而将肿瘤组织中浸润的杀伤性T细胞分离出来,用IL-12去刺激,发现杀伤性T细胞具备了抗肿瘤活性,直接证明了IL-12能激活杀伤性T细胞。
通过这些实验,科学家证明使用PD-1抗体进行治疗后,需要树突状细胞通过表达IL-12“授权”,杀伤性T细胞才能发挥抗肿瘤功能。
要是树突状细胞不“授权”或者“授权”受到干扰怎么办?这或许是免疫治疗无法在某些肿瘤中发挥作用的原因。
反过来想,我们是否可以人工增强树突状细胞的这种“授权”能力,增强免疫治疗的效果呢?
这需要我们知道树突状细胞生产IL-12是受到哪些因素的影响。
通过测序发现浸润到肿瘤组织中的树突状细胞生产IL-12时,是受到NF-κB通路调控的。而且,研究人员证明可以通过药物激活NF-κB信号通路,进而能增加IL-12的表达。
随后,他们在小鼠肿瘤模型中证明,在用PD-1抗体进行免疫治疗的同时,激活NF-kB信号通路进行联合治疗,可以显著提高免疫治疗的效果。
并且,科学家们还发现了额外的惊喜。联合治疗的效果最好
当小鼠的肿瘤被联合治疗治好后,再次给小鼠移植肿瘤时,肿瘤无法重建,小鼠保持了对肿瘤的免疫记忆!
当然,实际的效果还要等待进一步的研究,以及临床试验的验证。
这是科学家首次发现树突状细胞在免疫治疗中发挥了至关重要的作用,杀伤性T细胞的抗肿瘤活性需要由树突状细胞启动。这也提醒科学家,免疫治疗背后存在着复杂的作用机制,需要更加深入地探索。
对背后机制的揭示将有助于加深对癌症免疫治疗的了解,进而提高免疫治疗的效果。
Pittet博士说道:“激活NFkB通路增加了树突状细胞的数量和IL-12的表达,进一步增加了杀伤性T细胞的抗肿瘤活性。这表明,促进肿瘤内IL-12表达的药物可以进一步提升抗肿瘤反应。现在,我们需要更加深入地了解肿瘤中的树突状细胞,并探索激活这些细胞的药物是否对更多类型的肿瘤有效,以帮助更多的癌症患者。”[6]
编辑神叨叨
肿瘤与免疫系统的战争已经持续了无数年了,双方都施展了浑身解数想击败对方,真正的战争或许要远比我们想得更复杂~想了解最新医学的进展吗?都在这个小程序里~
参考资料:
[1]Christopher Garris, Sean Arlauckas, et al…. Mikael Pittet. (2018). Successful Anti-PD-1 Cancer Immunotherapy Requires T Cell-Dendritic Cell Crosstalk Involving the Cytokines IFN-g and IL-12. Immunity. DOI: 10.1016/j.immuni.2018.09.024
[2] Galon, J., Angell, H.K., Bedognetti, D., and Marincola, F.M. (2013). The continuum of cancer immunosurveillance: prognostic, predictive, and mechanistic signatures. Immunity 39, 11–26
[3] Nastala, C.L., Edington, H.D., McKinney, T.G., Tahara, H., Nalesnik, M.A., Brunda, M.J., Gately, M.K., Wolf, S.F., Schreiber, R.D., Storkus, W.J., et al. (1994). Recombinant IL-12 administration induces tumor regression in association with IFN-gamma production. J. Immunol. 153, 1697–1706.
[4] Hui, E., Cheung, J., Zhu, J., Su, X., Taylor, M.J., Wallweber, H.A., Sasmal, D.K., Huang, J., Kim, J.M., Mellman, I., and Vale, R.D. (2017). T cell costimulatory receptor CD28 is a primary target for PD-1-mediated inhibition. Science 355, 1428–1433
[5] Rooney, M.S., Shukla, S.A., Wu, C.J., Getz, G., and Hacohen, N. (2015). Molecular and genetic properties of tumors associated with local immune cytolytic activity. Cell 160, 48–61.
[6]https://www.massgeneral.org/about/pressrelease.aspx?id=2321
《细胞》子刊:PD-1抗体抗癌的真相,我们理解错了!麻省总医院科学家发现,与PD-1抗体结合的T细胞只有收到DC细胞的指令才抗癌http://t.jinritoutiao.js.cn/8wk8FD/
转载请注明:徐自远的乱七八糟小站 » 《细胞》子刊:PD-1抗体抗癌的真相,我们理解错了!麻省总医院科学家发现,与PD-1抗体结合的T细胞只有收到DC细胞的指令才抗癌