重磅:AD两大谜团终被破解!科学家确定aβ二聚体是阿尔茨海默病的真正毒蛋白,它能在超早期就破坏脑功能 | 科学大发现
一说到阿尔茨海默病(AD)奇点糕就想叹气,也不是科学家不努力,怎么老也搞不清楚它到底咋回事儿呢?
不说别的,就这个β淀粉样蛋白吧,人人都知道它是AD的关键病理特征,可是对它做了那么多研究,还是有两个最关键的问题像大山一样拦在前面:
一、β淀粉样蛋白有各种形式,可溶的不可溶的,低聚的高聚的,到底哪种是毒害神经元的主力军?
二、这些蛋白是炸楼了还是放火了,到底是怎么让神经元不正常工作的呢?
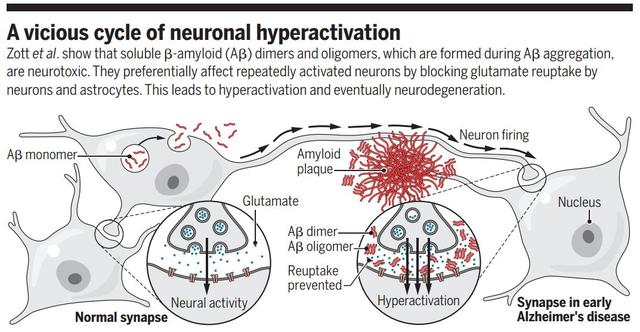
这两个问题,奇点糕今天要一口气都答了~根据《科学》杂志发布的一项最新研究成果,德国慕尼黑工业大学科学家发现,β淀粉样蛋白的二聚体是最主要的毒性蛋白形式,它们可以抑制神经元的谷氨酸再摄取,导致神经元过度活化[1]。
值得注意的是,这种导致神经元功能障碍的病理表现,出现得比神经纤维缠结、神经营养不良、脑萎缩等病理特征更早。联系到临床上谷氨酸受体拮抗剂美金刚的使用,针对谷氨酸能神经元或许是AD治疗值得关注的方向。
看来要搞AD还是得放宽视野,多管齐下呀!
说起AD的新药,那真是患者和药企共同的血泪史。研究了β淀粉样蛋白那么多年,以它为靶点的新药却一个接一个败下阵来。
说得不客气一些,至今为止试图减少或中和β淀粉样蛋白的药物,没有一个能够真的延缓AD的疾病进展,这让科学家不由得开始思考,β淀粉样蛋白在AD中真正的角色定位。由此也就产生了开头的两个问题:谁在作怪,以及怎么使坏。
先从神经元功能障碍开始说起吧。AD的发病机制复杂,近年来科学家们关注到了一个新的很有意思的现象——在AD患者的大脑内,有部分神经元会异常活跃,这对整个儿精细的认知神经回路显然是很有害的,也是AD患者常常出现癫痫发作的原因。
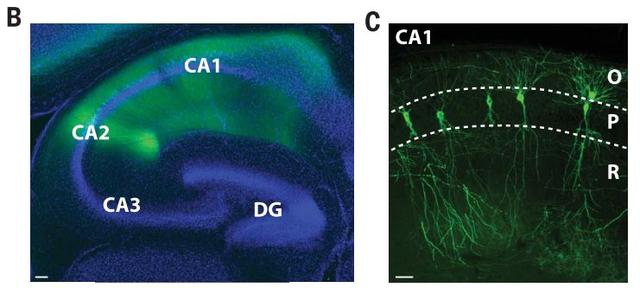
当科学家利用功能性磁共振成像(fMRI)来检测前驱性AD患者的大脑时,发现这样的神经元过度活动主要出现在海马和新皮质中,而这两个脑区也是β淀粉样蛋白大量积累的地方。
看起来这个神经元超兴奋的现象很可疑啊!
已经有科学家在小鼠中研究过超兴奋的分子机制,幕后黑手指向了可溶性β淀粉样蛋白。而今天这项研究又进一步挑明了它的真实姓名——β淀粉样蛋白的二聚体。
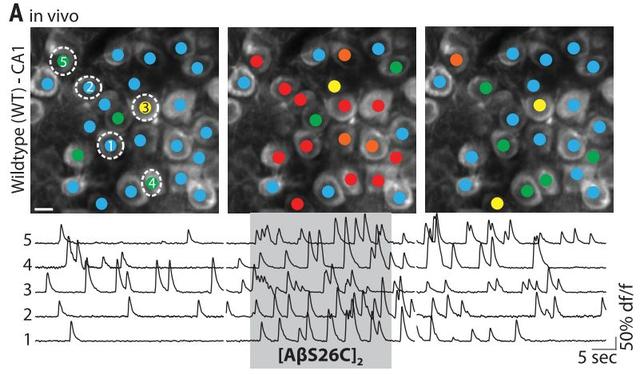
看,给小鼠注射了人工合成的二聚体之后,大脑海马体迎来了一波剧烈活动,这部分神经元明显谷氨酸含量超标。
研究者发现,给小鼠注射谷氨酸摄取拮抗剂也能够达到差不多的效果,说明β淀粉样蛋白二聚体应该是有类似的机制。
检查了各种和谷氨酸转运有关的受体之后,研究者发现关键居然是落到了星形胶质细胞上。原来β淀粉样蛋白并不是直接结合了某个受体,而是干扰了星形胶质细胞表面相关受体的扩散,这个步骤是清除突触释放的谷氨酸的关键步骤。就这样,它导致谷氨酸积累,也就让神经元只能兴奋个不停。
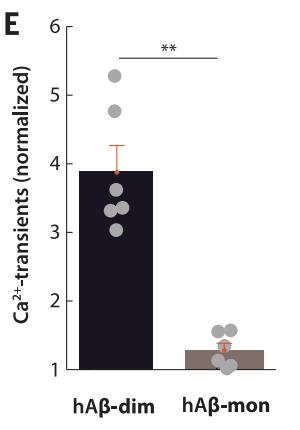
在AD模式小鼠中,研究者也进行了测试。无论是内源产生的β淀粉样蛋白还是从AD患者大脑中提取的β淀粉样蛋白二聚体,都能够造成同样的神经元兴奋。另外,除了二聚体之外的低聚物也能产生一定的效果,而β淀粉样蛋白单体就几乎没作用了。
这个现象出现得很早,神经元过度兴奋的小鼠还没来得及产生蛋白沉淀呢。
按照这个研究的说法,在β淀粉样蛋白单体聚集的过程中,二聚体和低聚物形成,它们是真正有神经毒性的蛋白形式。这些低聚物通过阻断神经元和星形胶质细胞对谷氨酸的再摄取,造成神经元过度激活,最终导致神经退化。
谷氨酸和AD的小秘密,从以前的研究中也能观察到一些端倪。首先,在AD模式动物和患者中,都存在谷氨酸稳态受损的现象;其次,一种抗谷氨酸药物美金刚,也已经用于阿尔茨海默病的治疗。
考虑到相关的现象比AD的其他临床症状出现得更早,那么靶向谷氨酸相关的通路,或许是AD早期治疗的可靠探索方向。毕竟等到神经元大规模罢工,我们就没有太好的手段去修复它们了。
《科学》重磅:AD两大谜团终被破解!科学家确定aβ二聚体是阿尔茨海默病的真正毒蛋白,它能在超早期就破坏脑功能 | 科学大发现http://t.zijieimg.com/DtVYXc/
转载请注明:徐自远的乱七八糟小站 » 《科学》重磅:AD两大谜团终被破解!科学家确定aβ二聚体是阿尔茨海默病的真正毒蛋白,它能在超早期就破坏脑功能 | 科学大发现